抑郁症俗称「心灵感冒」,作为现代社会一种常见、多发的精神障碍,它正严重危害人类身心健康,是全球范围的首要致残原因,给家庭、社会带来沉重负担。日前,海军军医大学心理系蒋春雷教授研究团队联合原解放军第 102 医院精神科,积极开展病患收治及临床试验,在国际情感障碍权威期刊 Journal of Affective Disorders 发表题为「Glycyrrhizic acid as an adjunctive treatment for depression through anti-inflammation: A randomized placebo-controlled clinical trial」的最新研究 [1]。
该研究主要论述中草药有效成分「甘草酸」在抗抑郁治疗中的应用价值,并初步阐释其分子机制,为抑郁症诊疗指南的修订建言献策。作者呼吁修订当前抑郁症诊疗策略,将炎症水平纳入抑郁症患者的入院常规检查项目(推荐检测血清 CRP,有条件可同时检测 IL-1β、TNF-α、IL-6 等),高炎患者在第一时间联用抗炎药物,提升抗抑郁药的治疗反应与临床疗效。该文的第一作者为曹志永博士,海军军医大学心理系应激医学教研室蒋春雷教授及苏文君博士为共同通讯作者。
目前为止,抑郁症的主要治疗策略仍然是药物治疗,指南主要推荐选择性 5-羟色胺再摄取抑制剂(Selective Serotonin Reuptake Inhibitor,SSRIs)、5-羟色胺-去甲肾上腺素再摄取抑制剂(Serotonin and norepinephrine reuptake inhibitors,SNRIs)等类型抗抑郁药物作为一线用药选择。然而,上述药物的临床疗效难以令人满意,近三分之二的抑郁症患者治疗初期无应答(用药数周后方可缓慢应答),约三分之一的患者药物治疗无效,最终发展成难治性抑郁(Treatment-resistant depression)。应答率低、起效慢等抑郁症药物治疗现状,对基于单胺假说的抑郁症经典治疗策略提出了挑战 [2]。
近年来,越来越多的研究证据表明,抑郁症的病理生理学机制与慢性低活度炎症反应及细胞因子失调有关 [3-5]。大样本 Meta 分析结果表明,与健康对照者相比,抑郁症患者的外周血促炎细胞因子水平升高,主要包括白细胞介素-1β(Interleukin-1β,IL-1β)、白细胞介素-6(Interleukin-6,IL-6)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)和干扰素-γ(Interferon-γ,IFN-γ)等 [6]。此外,在应用抗抑郁药物的治疗过程中,C 反应蛋白(C-reactive protein,CRP)等炎症相关生物标志物在难治性抑郁症患者血液中含量升高尤为明显,且其变化与疗效反应显著相关 [7, 8]。探索抑郁症的抗炎治疗新靶点,成为了扭转当前经典抗抑郁药物疗效不佳现状的新方向。
对此,国内外研究人员做出了许多尝试。早年间,Raison 等人 [8] 曾在临床试验中应用靶向 TNF-α的单克隆抗体英夫利昔(Infliximab)治疗难治性抑郁症,尽管由于试验设计、统计方法及检测手段等原因,最终疗效未能达到预期,但他们发现基线炎症相对较高的患者对该抗体治疗反应较好,抑郁症状改善更加明显;这表明炎症反应与抑郁症严重程度及疗效反应密切相关,若能有效调控难治性抑郁患者的炎症网络,将会取得良好效果。之后的系列类似有效的临床研究,也为蒋春雷课题组提出「纲举目张」式的抑郁症抗炎治疗提供了思路 [9, 10]。
众所周知,单克隆抗体制备流程复杂,研发成本昂贵,对大多数病患而言更是「天价」,不适合在抑郁症诊疗中大规模推广应用。此外,目前抑郁症抗炎疗法的适应症尚不明确,且亟需确定简便易测、稳定可靠的生理指标,用以提示治疗进展、评估患者预后。于是,筛选出客观适合的生理指标,对抑郁症患者的诊断进行深度分类,以及探寻安全、经济、有效的临床药物,改善传统抗抑郁药物起效慢、应答率低、副作用明显等特点,成为抑郁症炎症机制研究领域的两大重点与难点问题。
在本文介绍的这项研究中,研究人员首先进行了样本量计算,参照入组及排除标准对拟收治病患进行筛选,并采用随机、双盲、安慰剂对照的方法,将入组对象按 1:1 分配至 5-羟色胺再摄取抑制剂+甘草酸二铵肠溶胶囊组(SSRI+GZA)和 5-羟色胺再摄取抑制剂+安慰剂对照组(SSRI+PBO),并分别 在入组时以及治疗第 1 周末、第 2 周末和第 4 周末进行 17 项版汉密尔顿抑郁量表(Hamilton Depression Scale-17,HAMD-17)评定(图 2)。
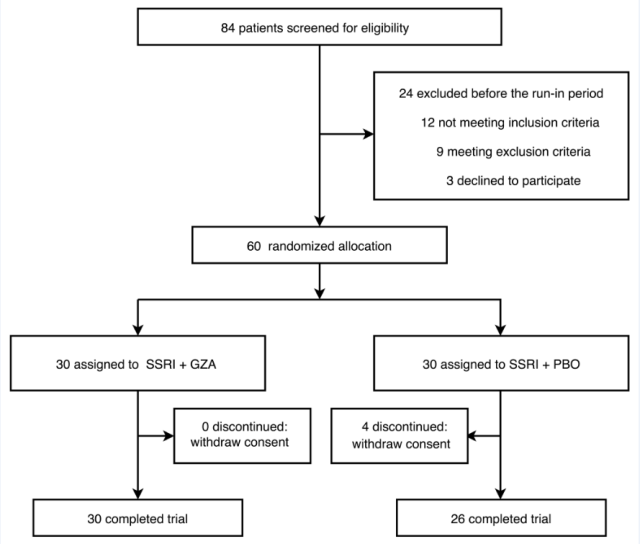
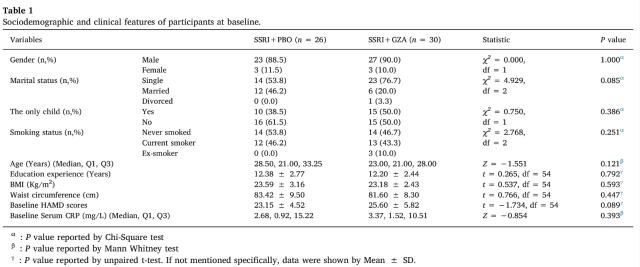
总体来看,SSRI+PBO 组纳入患者 26 例(男性 23 例,女性 3 例;年龄 19-61 岁,平均 30.1 岁);SSRI+GZA 组纳入患者 30 例(男性 27 例,女性 3 例;年龄 19-58 岁,平均 26.4 岁)。两组患者在性别、婚姻状况、独生子女情况、吸烟史、年龄、受教育经历、BMI、腰围、HAMD 量表评分及 CRP 基线值等方面的差异无统计学意义,提示两组患者在后续临床试验中具有可比性(表 1)。
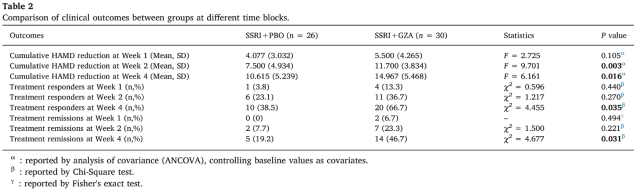
在为期 4 周的治疗观察期结束后,研究人员对主要疗效指标—HAMD-17 量表评分进行分析,并对治疗反应指标「有效」(Response)及「缓解」(Remission)进行比较。其中,「有效」是指治疗后抑郁症状减轻,该研究以主要疗效指标(HAMD-17 评分)变化率 ≥ 50 % 来定义;「缓解」是指治疗后抑郁症状(几乎)完全消失,此处以主要疗效指标(HAMD-17 评分)≤ 7 来定义。
通过对两组患者各观测点的 HAMD-17 累积减分值进行协方差分析(各组 HAMD-17 评分基线值为协变量),研究人员发现 SSRI+GZA 组在服药第 2 周末和第 4 周末的 HAMD-17 累积减分均高于 SSRI+PBO 组。类似地,在第 4 周末,SSRI+GZA 组患者的治疗有效率和缓解率均较 SSRI+PBO 组显著提高(表 2)。
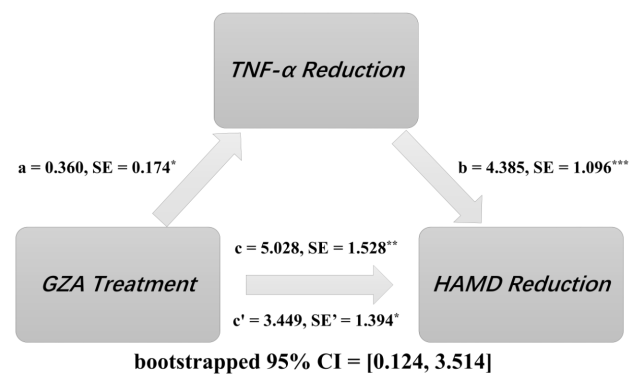
随后,研究人员还有针对性地检测了患者的部分血清生物学指标(皮质醇、CRP、TNF-α、IL-6、IL-1β、IFN-γ)。通过对这些指标各观测点的累积减低值进行协方差分析,研究人员证实:在第 4 周末时,SSRI+GZA 组 TNF-α与 IL-1β的累积减低值均较 SSRI+PBO 组显著提升,提示 SSRI+GZA 组的整体炎症状态得到了更好的改善,该结果与前述 HAMD-17 评分的临床指标一致(表 3)。
为了探讨联合 GZA 治疗、炎症与抗抑郁疗效之间潜在的相互作用,研究人员以是否接受 GZA 联合治疗为自变量,HAMD-17 的减分值为因变量,TNF-α浓度的降低为中介变量,参考 Andrew F. Hayes 等人提出的 bootstrap 模拟法构建了中介效应模型。分析结果表明,TNF-α的降低部分介导了 GZA 治疗与 HAMD 评分降低之间的关联(图 3)。
最后,考虑到合并抗炎治疗能够产生更优的抗抑郁效果,而 CRP 能够较好地反应机体近期炎症水平,研究者将前述纳入的患者重新按 CRP 浓度水平分为高炎和低炎亚组(以 3 mg/L 为界)进行回顾性探索,并对各个时点的 HAMD-17 累积减分值进行协方差分析。结果显示,在低炎患者中,SSRI+PBO 与 SSRI+GZA 组的效应差异并无统计学意义;但对于高炎患者而言,SSRI+GZA 组在第 2 周末及第 4 周末时 HAMD-17 累积减分值均显著高于 SSRI+PBO 组,这表明在高炎患者中合并抗炎治疗能产生更佳疗效(表 4)。由此,对抑郁症患者早期、准确地进行炎症水平检测显得尤为重要,高炎患者应当及时开展抗炎辅助治疗,增强治疗反应与临床疗效。

在该论文的讨论部分,作者指出,甘草酸是一种从甘草根中提取的天然化合物,迄今为止已在临床成熟应用 30 余年,主要用于改善肝炎相关的细胞坏死和纤维化,具有较好的安全性和有效性。关于其抗抑郁的可能机制,主要因为 GZA 可以作为高迁移率族蛋白 1(High mobility group box 1,HMGB1)的天然抑制剂与之结合,抑制该炎症细胞因子的活性,从而起到调控炎症因子网络的作用。而在早前的动物实验中,课题组业已证实,HMGB1 通过激活 TLR4 受体信号通路、调控 TNF-α等炎性细胞因子、影响犬尿氨酸代谢通路(Kynurenine pathway),最终介导抑郁样行为的产生;给予 HMGB1 抑制剂 GZA 可显著改善小鼠的抑郁样行为 [11-14]。考虑到 GZA 的广泛抗炎性、安全有效性和经济实用性,它作为一种抗抑郁辅助用药有着较好的应用前景。
尽管该文仍有一些缺憾,譬如单中心、样本量偏小、未直接检测 HMGB1,且随访观测时间较短,但为抑郁症的药物治疗提供了一个起效快、价格低、易获取的辅助用药选项,并为基于炎症网络机制的抑郁症诊断、分型、个体化治疗和预后评估提供了新策略。更重要的是,通过该研究,作者呼吁修订当前抑郁症诊疗规范,将炎症水平纳入抑郁症患者的入院常规检查项目(推荐检测血清 CRP,有条件可同时检测 IL-1β、TNF-α、IL-6 等),高炎患者需在第一时间联用抗炎药物,提升抗抑郁药的治疗反应与临床疗效。
参考文献
[1] Cao Z Y, Liu Y Z, Li J M, Ruan Y M, Yan W J, Zhong S Y, Zhang T, Liu L L, Wu R, Wang B, Wang W, Bi X Y, Wang Y X, Su W J, Jiang C L. Glycyrrhizic acid as an adjunctive treatment for depression through anti-inflammation: A randomized placebo-controlled clinical trial [J]. Journal of affective disorders, 2020, 265(247-254.
[2] Malhi G S, Mann J J. Depression [J]. The Lancet, 2018, 392(10161): 2299-2312.
[3] Su W J, Zhang Y, Chen Y, Gong H, Lian Y J, Peng W, Liu Y Z, Wang Y X, You Z L, Feng S J, Zong Y, Lu G C, Jiang C L. NLRP3 gene knockout blocks NF-kappaB and MAPK signaling pathway in CUMS-induced depression mouse model [J]. Behavioural brain research, 2017, 322(Pt A): 1-8.
[4] Zhang Y, Liu L, Peng Y L, Liu Y Z, Wu T Y, Shen X L, Zhou J R, Sun D Y, Huang A J, Wang X, Wang Y X, Jiang C L. Involvement of inflammasome activation in lipopolysaccharide-induced mice depressive-like behaviors [J]. CNS neuroscience & therapeutics, 2014, 20(2): 119-124.
[5] Zhang Y, Liu L, Liu Y Z, Shen X L, Wu T Y, Zhang T, Wang W, Wang Y X, Jiang C L. NLRP3 Inflammasome Mediates Chronic Mild Stress-Induced Depression in Mice via Neuroinflammation [J]. The international journal of neuropsychopharmacology / official scientific journal of the Collegium Internationale Neuropsychopharmacologicum, 2015, 18(8): pyv006-pyv006.
[6] Kohler C A, Freitas T H, Maes M, de Andrade N Q, Liu C S, Fernandes B S, Stubbs B, Solmi M, Veronese N, Herrmann N, Raison C L, Miller B J, Lanctot K L, Carvalho A F. Peripheral cytokine and chemokine alterations in depression: a meta-analysis of 82 studies [J]. Acta Psychiatr Scand, 2017, 135(5): 373-387.
[7] Chamberlain S R, Cavanagh J, de Boer P, Mondelli V, Jones D N C, Drevets W C, Cowen P J, Harrison N A, Pointon L, Pariante C M, Bullmore E T. Treatment-resistant depression and peripheral C-reactive protein [J]. The British journal of psychiatry : the journal of mental science, 2019, 214(1): 11-19.
[8] Raison C L, Rutherford R E, Woolwine B J, Shuo C, Schettler P, Drake D F, Haroon E, Miller A H. A randomized controlled trial of the tumor necrosis factor antagonist infliximab for treatment-resistant depression: the role of baseline inflammatory biomarkers [J]. Jama Psychiat, 2013, 70(1): 31-41.
[9] Su W J, Cao Z Y, Jiang C L. Blocking the trigger: An integrative view on the anti-inflammatory therapy of depression [J]. Brain, behavior, and immunity, 2019, 82(10-12.
[10] Su W J, Cao Z Y, Jiang C L. [Inflammatory mechanism of depression and its new strategy for diagnosis and treatment] [J]. Sheng li xue bao : [Acta physiologica Sinica], 2017, 69(5): 715-722.
[11] Wang B, Lian Y J, Su W J, Peng W, Dong X, Liu L L, Gong H, Zhang T, Jiang C L, Wang Y X. HMGB1 mediates depressive behavior induced by chronic stress through activating the kynurenine pathway [J]. Brain, behavior, and immunity, 2018, 72(51-60.
[12] Wang B, Lian Y J, Dong X, Peng W, Liu L L, Su W J, Gong H, Zhang T, Jiang C L, Li J S, Wang Y X. Glycyrrhizic acid ameliorates the kynurenine pathway in association with its antidepressant effect [J]. Behavioural brain research, 2018, 353(250-257.
[13] Lian Y J, Gong H, Wu T Y, Su W J, Zhang Y, Yang Y Y, Peng W, Zhang T, Zhou J R, Jiang C L, Wang Y X. Ds-HMGB1 and fr-HMGB induce depressive behavior through neuroinflammation in contrast to nonoxid-HMGB1 [J]. Brain, behavior, and immunity, 2017, 59(322-332.
[14] Wu T Y, Liu L, Zhang W, Zhang Y, Liu Y Z, Shen X L, Gong H, Yang Y Y, Bi X Y, Jiang C L, Wang Y X. High-mobility group box-1 was released actively and involved in LPS induced depressive-like behavior [J]. Journal of psychiatric research, 2015, 64(99-106.
